Miért fontos a CE jelölés? Egyáltalán miért kell elhelyezni egy orvostechnikai eszközre ezt a két betűt? Természetesen ezeket a kérdéseket leginkább „start up” cégektől szoktuk megkapni, mi tanácsadók. Alapvetően két fogalommal lehet megválaszolni ezt a kérdést. A CE jelölés az orvostechnikai eszközök hatékonyságát és biztonságát igazolja! Az orvostechnikai eszközök esetében különösen fontos a hatékonyság és biztonság, mivel az érdekelt személyek sokfélék, beleértve az egészségügyi dolgozókat, az egészségügyi szolgáltatást nyújtó intézményeket, a kormányzatokat, az ipart, a betegeket és az átlagembereket.
Az orvostechnikai eszközök piacán alapvető fontosságú annak biztosítása, hogy a termékfejlesztés megfeleljen az összes szabályozási követelménynek. A bonyolult klinikai és szabályozási követelmények megértése és figyelembevétele a termék életciklusának korai szakaszában biztosíthatja, hogy a vállalat a piacra kerülési idő csökkentésével versenyképessé váljon.
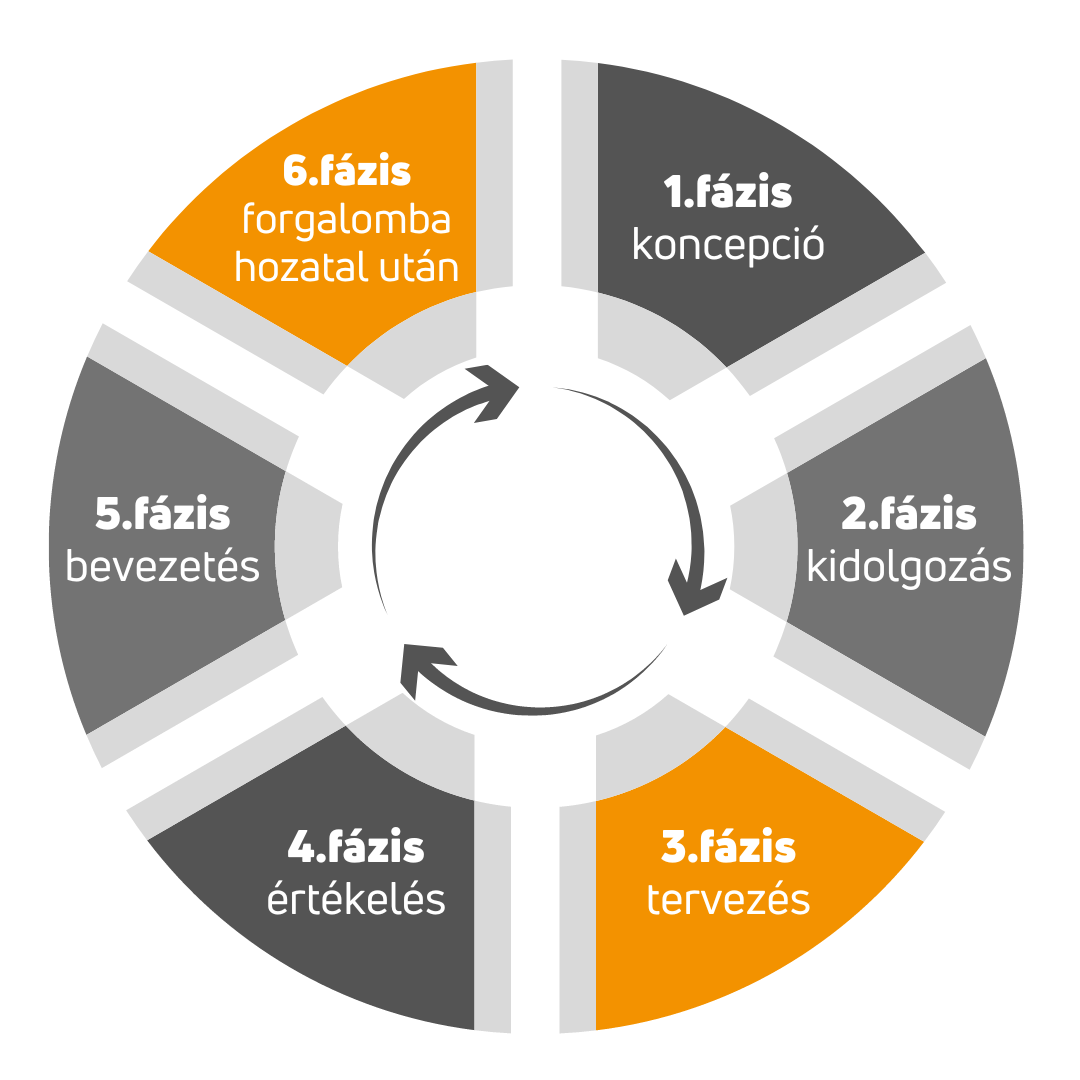
Ahhoz, hogy egy CE jelzett orvostechnikai eszközünk jelenjen meg a boltok piacán lényegében 6 lépésen kell végig mennünk, az ötlettől a gyártásérett prototípuson át, az elégedett és meggyógyult páciensig.
Az 1. fázisban azonosítani kell az orvostechnikai eszköz felhasználóit és azok igényeit, meg kell határozni az eszköz rendeltetését. Gyakorlatilag egy előzetes koncepciót kell összeállítania a gyártónak. A QTICS Medical konzultációk és képzések biztosításával segít a szabályozási követelmények összeállításában.
2. fázisban a felhasználói igények és műszaki követelmények alapján kell meghatározni a tervezés bemeneteit. A gyártó feladata finomítani a koncepciót, előállítani a követelmény dokumentumokat. QTICS Medical szakértő csapata ebben a fázisban készíti el a gyártó számára a Szabályozási stratégiát, melynek része az MDR szerinti CE jelölés bevezetési projektterve is, de itt tudjuk biztostani az előzetes biztonságtechnikai laborvizsgálatok elvégzését is.
A Tervezés fázisában történik a munka oroszlán része. Hiszen ebben a fázisban kell elvégezni az orvostechnikai eszköz biztonságtechnikai vizsgálatait, el kell készíteni a tervezés és fejlesztés dokumentumait, a termék tervezési és gyártási folyamatainak fejlesztését. A QTICS Medical segít a minőségirányítási rendszer kiépítésében, elkészíti a teljes MDR/IVDR szerinti műszaki dokumentációt, de vizsgálólaborjaink elvégzik a szükséges pre-klinikai biztonságtechnikai vizsgálatokat is.
A 4. fázisban történik az orvostechnikai eszköz és a gyártási folyamatok végső validálása, szükség esetén a klinikai vizsgálat lefolytatása. Klinikai szakértőink a klinikai vizsgálati stratégia alapján elvégzik a klinikai vizsgálatot, amennyiben szükséges. Másrészt tanácsadóink közreműködésével segítünk a címke és használati útmutató véglegesítésében, támogatjuk a regisztrációt az Eudamed adatbázisban.
A Bevezetés szakaszban történik a megfelelőségértékelési eljárás és a termék bevezetése. A bejelentett szervezet helyszíni auditja során támogatjuk a gyártót.
Az utolsó, 6. fázisban kell elvégezni a forgalomba hozatal utáni felügyeleti tevékenységet. Itt történik a vevői panaszok és súlyos váratlan események kezelése. A minőségirányítási rendszer és műszaki dokumentáció karbantartása mellett, a QTICS Medical elkészíti a szükséges PMS és PMCF terveket, jelentéseket is.
Fentieket összegezve, nem egyszerű egy orvostechnikai eszköz fejlesztése és a CE jelölés megszerzése, ahogyan egy többezer méter magas hegycsúcsra sem könnyű feljutni. Viszont, ha viszünk magunkkal segítségként oxigénpalackot, térképet, serpákat, akkor nagyobb esélyünk van feljutni a csúcsra. Ezért bátorítunk mindenkit, hogy vegye igénybe a QTICS Medical szolgáltatásait és segítünk teljesíteni ezt a 6 lépcsős túrát.
