
A hazai egészségügyi piac egyik legjelentősebb vállalatának minőségirányítási vezetője, Hajdu Csaba mesélt nekünk az MDR átállás sikeres teljesítéséről és a folyamat során tapasztalt kihívásokról.
Milyen eszközöket forgalmaz a HARTMANN-RICO Hungária Kft.?
Bár cégünk Magyarországon 25 éve, 1997. november 1-jén alakult, mégsem tekinthető új vállalkozásnak, hiszen egyesíti a multinacionális Paul HARTMANN AG. és a Magyarországon több mint 100 éves múltra visszatekintő RICO Kötszerművek szaktudását és tapasztalatát. A két patinás cég nevével fémjelzett vállalat a magyar egészségügy és fogyasztási cikk piac részére egyedülállóan széles és jó minőségű választékot kínál. A Class I-től a Class III-ig bezárólag minden kockázati osztály érintett a forgalmazott termékekkel kapcsolatban. A HARTMANN klasszikus termékcsoportja a hagyományos kötszerek mellett az innovatív modern sebkezeléshez szükséges kötszerek és a negatívnyomás-terápia termékei. A sebkezelés mellett kínálunk inkontinencia és betegápolási termékeket, egyszer használatos, steril és nem steril műtéti izolációs ruházat, lepedők és szettek széles választékát, valamint a kórházi ellátás során végzett főbb beavatkozások támogatására összeállított szetteket. Igen fontos kategória a sztómaviselők számára biztosított termékek és kiegészítők rendszere. Végül, de nem utolsó sorban a széles fertőtlenítőválasztékunk közül azon eszközök, amelyek orvostechnikai eszközként kerültek engedélyezésre.
Mikor indult el az MDR átállási folyamat és milyen fontos előkészületeket tettek az indulás előtt?
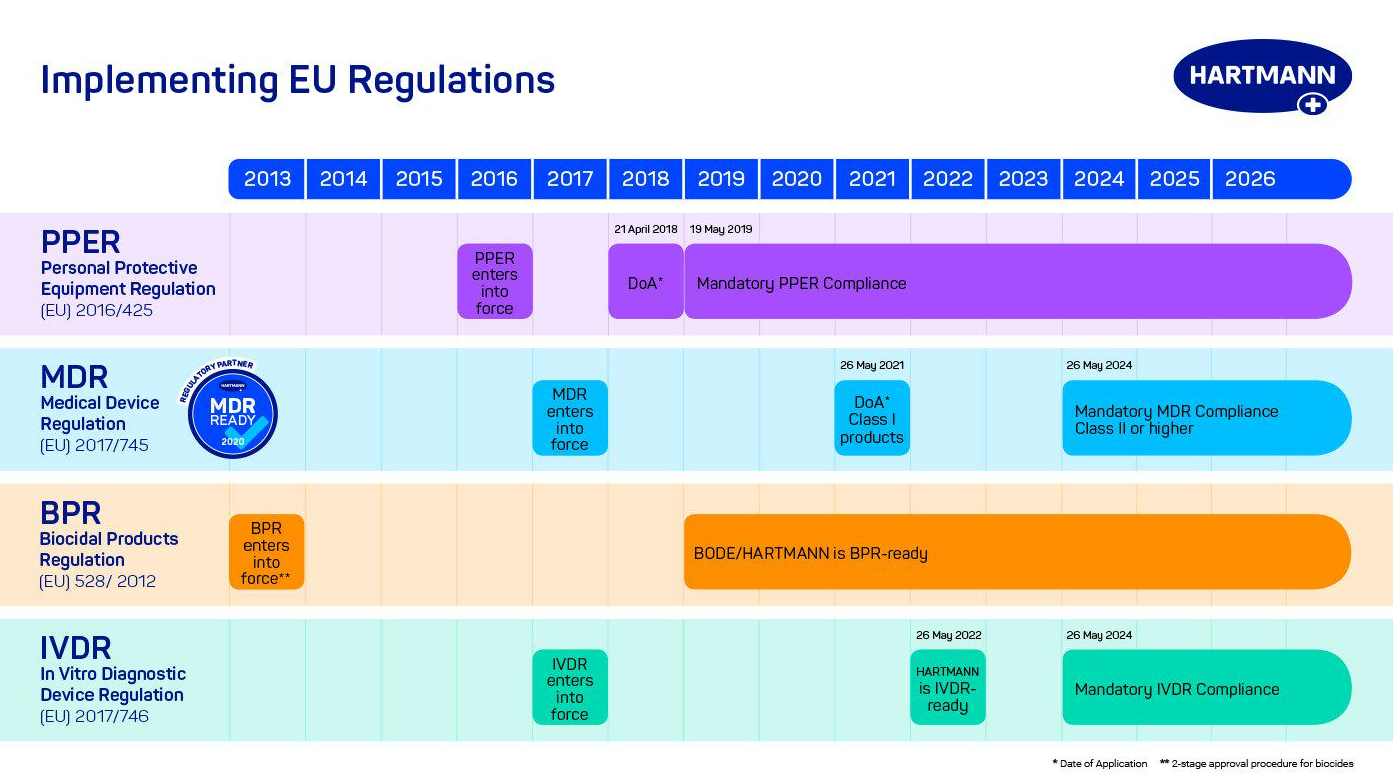
A HARTMANN támogatja ügyfeleit azáltal, hogy termékei megfelelnek a különböző előírásoknak. Az orvostechnikai (MDR) és az in vitro diagnosztikai eszközökről (IVDR) szóló rendeletektől, a személyi védőfelszerelésekről szóló (PPER) szabályozáson keresztül, a biocid termékek engedélyezéséről (BPR) szóló szabályozásig, elkötelezettek vagyunk megfelelőségi cselekvési terveink iránt, hogy az egészségügyi szakemberek és partnereink a legnagyobb biztonságban gondoskodhassanak a betegekről.
Cégünk legfontosabb feladatainak egyike volt az MDR követelményeire való felkészülés, a várható feladatok meghatározása, mivel tudott volt azok összetettsége és az előreláthatólag hosszú átállási időszak. Ennek érdekében az első un. „MDR átállási stratégia” tervezet 2018. áprilisában került meghatározásra.
A felkészülésünk első lépései voltak:
• A Rendelet tanulmányozása, értelmezése, elsősorban a forgalmazóra vonatkozó részek tekintetében.
• A vezetőség tájékoztatása annak biztosítására, hogy mindenki megértse az MDR fontosságát és az üzleti tevékenységre gyakorolt hatásait.
• A forgalmazott eszközök kapcsán jelentkező kockázatok elhárítása vagy enyhítése érdekében, a rendelkezésre álló kockázatkezelés ellenőrzése, valamint a hiányosságok azonosítása.
• A minőségirányítási rendszer áttekintése és módosítási területek meghatározása.
.png)
Az MDD alatt elkészült dokumentációkat mennyiben tudták felhasználni?
A HARTMANN-RICO Hungária Kft., mint forgalmazó – rendelkezett az alaptevékenység végzéséhez szükséges és elengedhetetlen belső szabályozó dokumentumokkal. A direktíva és a hazai szabályozásnak megfelelő és dokumentált folyamatok megfelelő alapot biztosítottak az új követelmények bevezetéséhez azzal, hogy azokat az MDR előírások szerint kellett különböző mértékben módosítani, kiegészíteni, így többek között:
• Raktározási, termék ellenőrzési követelmények kidolgozása - A nyomon követhetőségi kötelezettségek betartásának biztosítása. (14. cikk 3. bekezdés)
• A beérkezett panaszok kivizsgálásának, nyilvántartási rendszerének a felülvizsgálata. (14. cikk 5. bekezdés)
• A hatósággal történő együttműködés szabályozása. (14. cikk 6. bekezdés)
Milyen feladatmegosztásban hajtották végre az átállás folyamatát?
Egy új regulációra történő átállás végrehajtása nem egy egyszemélyes feladat. A vállalat szinte minden szervezeti egységét érintő folyamatok széleskörűek és összetettek, ezért magas színtű csapat munkát követel meg. A HARTMANN-RICO felső vezetése az érintett osztályokkal együtt megértette és elfogadta az MDR filozófiáját és az értékesítési lánc minden szereplőjére vonatkozó felelősséget. A vezetőség a kezdetektől biztosított minden szükséges belső erőforrást. Az érintett osztályok magas szintű együttműködést tanúsítva kezdték meg haladéktalanul az érdemi munkát.
Milyen feladatok kapcsán vontak be külső szakértőt, illetve vizsgáló laborokat?
Az orvostechnikai eszközökre vonatkozó új európai jogszabály – a korábbiaktól eltérően - egy nagyon összetett dokumentum. A követelmények pontos értelmezése és az azokkal összefüggő aktivitások, dokumentációk meghatározásának érdekében szükségesnek éreztük egy külső, független szakértő bevonását. Több évre visszanyúló szakmai kapcsolat alapján a QTICS Group egyik tagvállalatával, a SAASCO Kft.-vel vettük fel a kapcsolatot, aki aktívan vett részt a tervezési és a végrehajtási szakaszban is, ennek köszönhetően minden követelmény feldolgozásra került. Ennek is köszönhetően az átállás során semmilyen fennakadás nem lassította a folyamatot. A jó kapcsolat jó kapcsolatot terem elv alapján a QTICS Group Zrt-vel is kialakult egy értékes szakmai együttműködés és – figyelembe véve az általa biztosított szolgáltatási kört, többek között az oktatási és szakértői szolgáltatásokat, értékeléseket, tanácsadást – számunkra egyértelmű, hogy indokolt a QTICS Group és tagvállalataival felvenni a kapcsolatot és támogatásukkal végrehajtani az átállási folyamatot.
Melyek voltak a legnagyobb kihívást jelentő feladatok/csapdák?
Bár a HARTMANN-RICO Hungária Kft. nem gyártóként van jelen a hazai egészségügyi piacon, de az anyacégünkkel és a gyártókkal történt folyamatos kapcsolattartásunk során egyértelművé vált, hogy a nyomon követhetőséget biztosító belső informatikai folyamatok kialakítása nagy kihívást jelent minden piaci szereplő számára.
Forgalmazói szerepünkkel kapcsolatos adminisztratív kötelezettségeknek való megfelelés biztosítása és a gyártói dokumentációk időben történő rendelkezésen tartása is komoly feladat volt a kollégák részére.
Folyamatos és nagy jelentőséggel bír (még napjainkban is) a meglehetősen bonyolult, sok részhatáridőt tartalmazó, és gyakran változó időrend kommunikációja a munkatársak és a partnereink részére.
Melyek voltak az átállási folyamat legfontosabb tanuláságai, melyre mindenképpen felhívnák a hazai gyártók figyelmét?
Amint az ismeretes, a folyamat során a törvényalkotó számos alkalommal módosított határidőket, rendszerint azokat későbbre halasztotta. Piaci információink szerint ezek a módosítások arra „ösztönözték” a gyártókat és egyéb piaci szereplőket, hogy „ej, ráérünk arra még!”. Tapasztalat, hogy nem, nem érnek rá, kiváltképp, ha mint gyártó kell, hogy megfeleljenek a vonatkozó követelményeknek. Az MDR szerinti tanúsítvány megszerzése az alapos előkészületek és külső szakértő folyamatos alkalmazása esetén is hosszú, időigényes folyamat. A gyártók részére új és összetett feladat az egyedi eszközazonosítási rendszerük kialakítása, az azonosítási forma helyes alkalmazása, ezzel együtt az MDR-nek megfelelő címketartalom meghatározása. És akkor az európai EUDAMED és a hazai NOR bejelentésekről még nem is beszéltünk.
Az MDR (14. cikk, 2. bekezdés) lehetővé teszi a forgalmazók szúrópróbaszerű inspekcióját. Javasoljuk, a gondossági kötelezettség teljesítésének részeként ők maguk is ellenőrizzék a termékek CE-jelölését, a megfelelőségi nyilatkozat és a Basic UDI (Alapvető egyedi eszközazonosító) szám meglétét és megfelelően dokumentálják az ellenőrzést. Ezért kiemelten fontos a gyártókkal való folyamatos együttműködés és kommunikáció.
Összességében hogyan értékelik az MDR által megfogalmazott követelményeket?
Társaságunk feltételek nélkül és meggyőződéssel támogatja az MDR legfontosabb alapelveinek megvalósulását: mindenekelőtt az eszközök biztonságos használatát, a gyártásra és a forgalmazásra vonatkozó szigorúbb szabályozást és nem utolsó sorban a forgalomba helyezett eszközökre vonatkozó szigorúbb piacfelügyeletet. Ma a HARTMANN azon kevés cégek egyike, amelyek már a hivatalos határidő előtt megfeleltek az MDR követelményeinek! Felelősségünk egyértelmű: mi gondoskodunk a szabályozásokról, hogy partnereink biztonságosan gondoskodhassanak betegeikről, ezért kezdtük el már évekkel ezelőtt végrehajtani a szabályozási akciótervünket az MDR bevezetésére.
HARTMANN, az MDR úttörő

